Атом кислорода в пероксиде водорода находится в промежуточном состоянии окислени я-1 и может понизить состояние окисления д о-2 в присутствии восстановителей: 4H2O2 + PbS = PbSO4 + 4H2O.
Окислительно-восстановительные реакции (ОВР в химии) — что это такое?
С древних времен ученые считали, что окисление — это потеря флюса (особого невидимого топлива, термин ввел Иоганн Бехер), а восстановление — его приобретение. Однако после создания А. Лавуазье в 1777 году теории горения кислорода, в начале XIX века химики стали рассматривать взаимодействие веществ с кислородом как окисление, а восстановление — как их превращение под действием водорода. Однако в качестве окислителей могут выступать и другие элементы, например.
Согласно электронно-ионной окислительно-восстановительной теории, созданной Л. Писаржевским в 1914 году, окисление — это процесс, при котором электроны отрываются от атомов или ионов окисляемого элемента; восстановление — это процесс, при котором электроны связываются с атомами или ионами восстанавливаемого элемента. Например, в реакции атом цинка теряет два электрона, т.е. окисляется, а молекула хлора присоединяется, т.е. восстанавливается.
Понятие окислительно-восстановительной реакции
Окислительно-восстановительные реакции (ORR) — это процессы, в которых изменяются степени окисления атомов химических элементов.
Окисление и восстановление идут рука об руку. Один процесс немыслим без другого. А почему бы и нет?
Изменение степени окисления всегда означает, что электроны передаются от одной частицы к другой. Другими словами, в ходе химических или электрохимических взаимодействий одни частицы отдают электроны, а другие их принимают. Именно здесь вступает в силу закон сохранения материи.
Важнейшие окислители и восстановители
Какие вещества могут действовать как окислители, а какие — как восстановители? Как уже говорилось, окислитель содержит элемент, степень окисления которого уменьшается, а восстановитель — элемент, степень окисления которого увеличивается в ходе реакции. Поэтому окислители могут состоять в основном из элементов с более высокой степенью окисления, а восстановители — в основном из элементов с более низкой степенью окисления.
Металлы имеют только положительную степень окисления в своих соединениях, а их низшая степень окисления равна нулю. Другими словами, они имеют низшую степень окисления только в свободном состоянии. Фактически, все свободные металлы могут обладать только восстановительными свойствами, хотя и в большей или меньшей степени. На практике в качестве восстановителей используются алюминий, магний, натрий, калий, цинк и некоторые другие металлы. Если металл имеет различные степени окисления, то соединения, в которых он имеет наименьшую степень окисления, часто также являются восстановителями, например, соединения железа (II), олова (II), хрома (II), меди (I).
Окисляющими агентами могут быть соединения тех металлов, в которых степень окисления металла высока, равна или близка к номеру группы, в которой находится металл. На практике, в частности, используют аммиачный раствор оксида серебра, аммиачный раствор купороса меди(II), хлорид ртути(II) и диоксид свинца.
Неметаллы проявляют как положительную, так и отрицательную степень окисления. Разумеется, соединения, содержащие неметаллы в более высокой положительной степени окисления, могут быть окислителями, а соединения, в которых неметалл имеет отрицательную степень окисления, могут быть восстановителями.
Восстановители, обычно используемые в промышленности, включают водород, углерод (в виде углерода или кокса) и монооксид углерода.
Неметаллы в верхних частях групп VI и VII таблицы Менделеева классифицируются как сильные окислители. Сильные окислительные свойства этих веществ объясняются высокой электроотрицательностью их атомов. Окислительные свойства фтора более выражены, но на практике в качестве окислителей чаще используются кислород, хлор и бром.
Кислоты также считаются окислителями. Наиболее важными на практике являются соляная, серная и азотная кислоты. Окислителем в соляной кислоте является водород, в азотной кислоте — азот, в разбавленной серной кислоте — водород, в концентрированной серной кислоте — сера. Таким образом, уравнение процесса экстракции разбавленной соляной и серной кислот имеет вид:
Азотная кислота может быть восстановлена до различных степеней окисления азота в зависимости от концентрации, температуры и типа восстановителя. Одним из наиболее распространенных продуктов восстановления является монооксид азота.
При восстановлении концентрированной серной кислоты также могут образовываться различные продукты. Одним из них может быть диоксид серы:
Классификация
Существует четыре типа ОВР:
- межмолекулярные: атомы окислителя и восстановителя находятся в молекулах разных веществ: MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O;
- внутримолекулярные: атомы окислителя и восстановителя входят в состав одного вещества: 2KClO3 = 2KCl + 3O2;
- диспропорционирование или самоокисление-самовосстановление — атом одного и того же элемента выполняет функцию восстановителя и окислителя: 4K2SO3 = 3K2SO4 + K2S (в K2SO4 сера — восстановитель, в K2S — окислитель);
- противопропорция — атомы одного элемента в составе исходных веществ имеют разную степень окисления, а конечные — одинаковую: S + 4O2 + 2H2S + 2 = 3S0 + 2H2O.
Процесс окисления (отдача электронов) обозначается знаком минус, показывающим, сколько электронов получил окислитель: S-2 — 2E → S0, Al0 — 3E → Al + 3, Fe + 2 — E → Fe + 3 Процесс восстановления (присоединение электронов) обозначается знаком плюс: Mn+4 + 2E → Mn+2, S0 + 2E → S-2, Cr+6 + 3E → Cr+3.
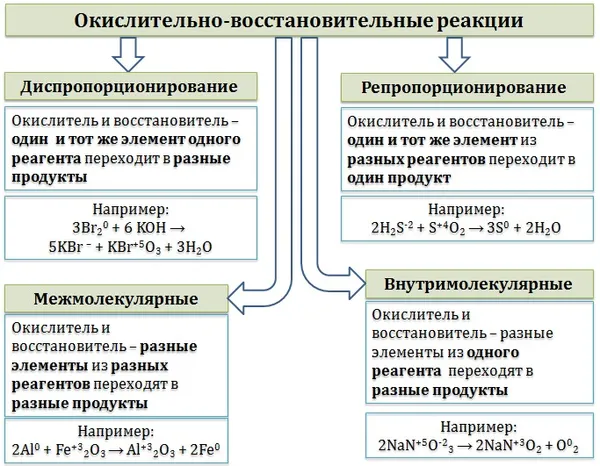
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции обычно делят на четыре типа: межмолекулярные, внутримолекулярные, реакции диспропорционирования (автоокисления-самовосстановления) и реакции антидиспропорционирования.
В межмолекулярных реакциях степень окисления различных элементов изменяется под действием различных реагентов. При этом образуются различные продукты окисления и восстановления.
2 Al 0 + Fe +3 2O3 → Al +3 2O3 + 2 Fe 0 ,
C 0 + 4H N +5 O3 (конденсат) = C +4 O2 ↑ + 4 N +4 O2 ↑+ 2H2O.
Внутримолекулярные реакции — это реакции, в которых окисляющие и восстанавливающие элементы объединяются в одном веществе:
2 Na N +5 O-2 3 → 2 Na N +3 O2 + O 0 2↑.
Реакции диспропорционирования (автоокисления-самовосстановления) — это реакции, в которых окисляющим и восстанавливающим элементами являются одни и те же элементы одного и того же реагента, которые вступают в реакцию с образованием различных продуктов:
3Br2 + 6 KOH → 5KBr + KBrO3 + 3 H2O,
Реакции восстановления (коммутация, антикондукция) — это реакции, в которых окислителем и восстановителем является один и тот же элемент, превращающийся из разных реагентов в один и тот же продукт. Реакции, противоположные диспропорционированию.
2H2 S-2 + S +4 O2 = 3 S + 2H2O
Основные правила составления окислительно-восстановительных реакций
Окислительно-восстановительные реакции сопровождаются процессами окисления и восстановления:
Окисление — это процесс отдачи электронов восстановителем.
Восстановление — это процесс отдачи электронов окисляющим агентом.
Окисляющий агент восстанавливается, а восстанавливающий — окисляется.
В реакциях окисления-восстановления существует электронный баланс: количество электронов, отданных восстановителем, равно количеству электронов, принятых окислителем. Если баланс нарушен, вы не сможете получить сложные БВД.
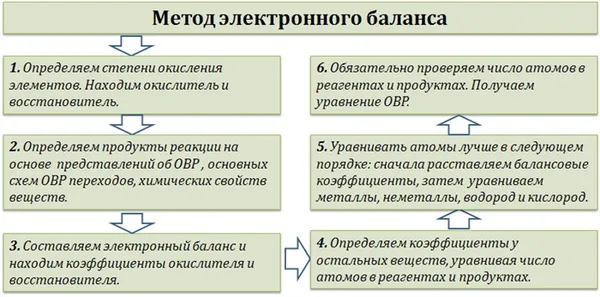
Существует несколько методов составления окислительно-восстановительной реакции (ОВР): метод электронного баланса, метод электронно-ионного баланса (метод полураспада) и другие.
Мы подробно рассмотрим метод электронного баланса.
«Идентификация» ОВР довольно проста — мы просто расставляем степени окисления во всех соединениях и находим, что атомы меняют степень окисления:
K + 2 S-2 + 2K + Mn +7 O-2 4 = 2K + 2 Mn +6 O-2 4 + S 0
Запишите отдельно атомы элементов, которые изменяют свою степень окисления ДО и ПОСЛЕ реакции.
Атомы марганца и серы изменяют свою степень окисления:
S-2 -2e = S 0
Mn +7 + 1e = Mn +6
Марганец приобретает 1 электрон, сера отдает 2 электрона. В этом случае необходимо соблюдать баланс электронов. Поэтому количество атомов марганца должно быть удвоено, а количество атомов серы должно остаться неизменным. Коэффициенты равновесия должны быть указаны как перед реактивами, так и перед продуктами!
Схематические уравнения ОВР по методу электронного баланса:
Внимание! В реакции может присутствовать более одного окислительного или восстановительного агента. Равновесие должно быть таким, чтобы ОБЩЕЕ число отданных электронов и число полученных электронов были равны.
Общие закономерности протекания окислительно-восстановительных реакций
Продукты окислительно-восстановительных реакций часто зависят от условий проведения процесса. Давайте теперь рассмотрим наиболее важные факторы, влияющие на возникновение окислительно-восстановительных реакций.
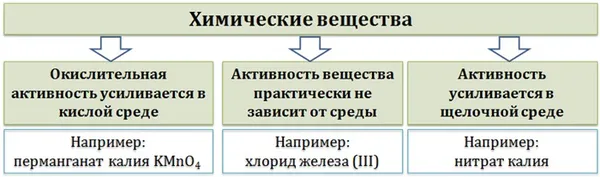
Наиболее очевидным определяющим фактором является то, является ли реакционный раствор кислым, нейтральным или щелочным. Обычно (но не обязательно) вещество, определяющее среду, упоминается среди реагентов. Возможны и такие вариации:
- окислительная активность усиливается в более кислой среде и окислитель восстанавливается глубже (например, перманганат калия, KMnO4, где Mn +7 в кислой среде восстанавливается до Mn +2, а в щелочной — до Mn +6 );
- окислительная активность усиливается в более щелочной среде, и окислитель восстанавливается глубже (например, нитрат калия KNO3, где N +5 при взаимодействии с восстановителем в щелочной среде восстанавливается до N -3 );
- либо окислитель практически не подвержен изменениям среды.
Реакционная среда определяет состав и форму существования других продуктов ОВР. В основном образуются продукты, которые не взаимодействуют с реагентами!
Обратите внимание! Если среда раствора кислая, то основания и основные оксиды не будут присутствовать среди продуктов реакции, так как они реагируют с кислотами. В щелочной среде, напротив, образование кислот и кислотных оксидов исключено. Это одна из самых распространенных и серьезных ошибок.
Природа реактивов также влияет на направление процесса ТИА. Например, если азотная кислота HNO3 с восстанавливающими веществами: Чем выше активность восстановителя, тем сильнее происходит восстановление азота N+5.
С повышением температуры большинство ТИА протекает интенсивнее и глубже.
В гетерогенных реакциях на состав продукта часто влияет степень измельчения твердого вещества. Например, порошкообразный цинк образует с азотной кислотой одни продукты, а гранулированный цинк — совершенно другие. В целом, чем выше степень грануляции реагента, тем выше его активность.
Рассмотрим наиболее типичные лабораторные окислители.
Примеры веществ-восстановителей
Типичными восстановителями могут быть щелочные (AA) и щелочноземельные (IA) металлы, цинк и алюминий, а также катионы металлов в их низшей степени окисления в различной степени. Например, возможны окислительные соединения кислот в различной степени:
Типичными восстановителями могут быть также бескислородные кислоты и их соли. Например: H2S + 4Cl2 + 4H2O = 8HCl + H2SO4.
Гидриды активных металлов (щелочных и щелочноземельных) также являются типичными восстановителями. Например: NaH + H2O = NaOH + H2.
Чтобы облегчить вашу работу, мы собрали в одном месте цвета переходов наиболее важных восстановителей.

Окислительно-восстановительная двойственность
Окислительно-восстановительная двойственность — это способность атома проявлять как окислительные, так и восстановительные свойства в зависимости от условий химической реакции.
Рассмотрим вещества, атомы которых проявляют окислительно-восстановительную двойственность.
Сера
По отношению к водороду и металлам сера играет роль окислителя: S + H.2 = H2S.
При взаимодействии с сильными окислителями она повышает свою степень окисления до +4 или +6: S + KMnO4 = K2SO4 + MnO2.
Кислородсодержащие соединения серы в степени окисления +4
Сера в сульфатах и серной кислоте при взаимодействии с сильными окислителями повышает свою степень окисления до +6: SO2 + 2HNO3 (концентрированная) = H2SO4 + 2NO2.
Соединения серы реагируют с восстановителями, восстанавливаясь до степени окисления 0 ил и-2: SO2 + C = CO2 + S.
Пероксид водорода
Атом кислорода в пероксиде водорода находится в средней степени окислени я-1 и может понизить степень окисления д о-2 в присутствии восстановителей: 4H2O2 + PbS = PbSO4 + 4H2O.
Атом кислорода в пероксиде водорода находится в средней степени окислени я-1 и может повышать степень окисления до 0 в присутствии окислителей: 3H2O2 + 2KMnO4 = 3O2 + 2MnO2 + 2KOH + 2H2O.
Простое вещество йод
Окислительная способность йода проявляется в реакции с восстановителями, такими как сероводород, фосфор и металлы: I2 + H2S = S + 2HI.
При взаимодействии с более сильными окислителями йод играет роль восстановителя: I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl.
Азотистая кислота и нитриты
При взаимодействии с более сильными окислителями азот повышает свою степень окисления до +5 и преобразуется либо из азотной кислоты в азотистую, либо из аниона азота в анион азота: 5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O.
При взаимодействии с сильными восстановителями обычно происходит восстановление до NO (иногда и до других соединений азота с более низкой степенью окисления): 2HNO2 + 2HI = 2NO + I2 + 2H2O.
Для простоты мы обобщили представителей типичных окислительных и восстановительных агентов в виде диаграммы.

Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции можно разделить на четыре типа:
- межмолекулярные ОВР;
- внутримолекулярные ОВР;
- реакции диспропорционирования;
- реакции контрпропорционирования.
Рассмотрим каждый из них отдельно.
Межмолекулярная ОВР — это реакция, в которой окислитель и восстановитель являются разными веществами.
2KI + Br2 = 2KBr + I2где Br2 — окислитель, а KI — восстановитель (из-за I-1 ).
Межмолекулярная ОВР — это реакция, в которой один атом является окислителем, а другой — восстановителем в одном и том же соединении.
Пример такой окислительно-восстановительной реакции:
Cl +5 — окислитель, а O-2 — восстановитель.
Термическое разложение нитратов представляет собой внутримолекулярную ОВР. На следующей диаграмме показано разложение нитратов в зависимости от металла соли.

Исключением является разложение нитрата железа(II): 4Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2. Здесь, вопреки правилам, железо окисляется до +3. Нитрат аммония по-разному разлагается при нагревании: NH4NO3 = N2O + 2H2O.
Окислительно-восстановительная реакция — это реакция, в которой один и тот же атом является и окислителем, и восстановителем. Например: 3HNO2 = HNO3 + 2NO + H2O, где N +3 превращается в N +5, восстановитель, а N +3 превращается в N +2, окислитель.
Окислительно-восстановительная реакция — это реакция, в которой атомы одного и того же химического элемента в разных состояниях окисления переходят в разные вещества, образуя новые молекулы одного и того же продукта.
Способность к окислению и восстановлению: как определить
Существует ряд закономерностей, по которым можно определить, обладает ли частица (атом, ион, молекула) способностью окисляться или восстанавливаться. Давайте посмотрим на периодическую таблицу химических элементов..
1) В периодах слева направо (то есть по возрастанию атомного номера элемента) восстановительные свойства простых веществ уменьшаются, а окислительные — увеличиваются:
То есть в начале периода есть явные восстановители, а в конце — окислители. Например, в III периоде активным восстановителем является натрий, а активным окислителем — хлор.
Причина этой закономерности кроется в структуре атомов элементов.
Атомы элементов одного периода:
- количество энергетических уровней остается постоянным (так, у элементов III периода их три);
- число электронов внешнего уровня растет (например, от 1 электрона у натрия и до 7 электронов у хлора).
Притяжение электронов к ядру также увеличивается. В результате радиус атома уменьшается.
2) Элементы второстепенных подгрупп (металлы четного ряда с длинными периодами) имеют 2 или 3 (редко 1 в случае «вакуума») электрона на внешнем уровне, поэтому они могут легко отдавать их и, таким образом, являются восстановителями:
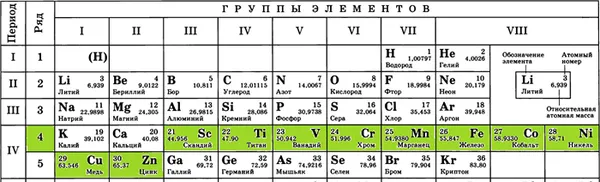
3) элементы одной и той же главной подгруппы имеют одинаковое число электронов на внешнем энергетическом уровне (например, элементы VI группы имеют шесть электронов). С увеличением числа энергетических уровней увеличиваются и радиусы атомов. Это приводит к тому, что электроны на внешних уровнях удаляются от ядра, и их притягивающая сила на ядре уменьшается.
По этой причине сила восстановления (способность отдавать электроны) элементов главных подгрупп увеличивается сверху вниз, а сила окисления (способность принимать электроны) уменьшается:
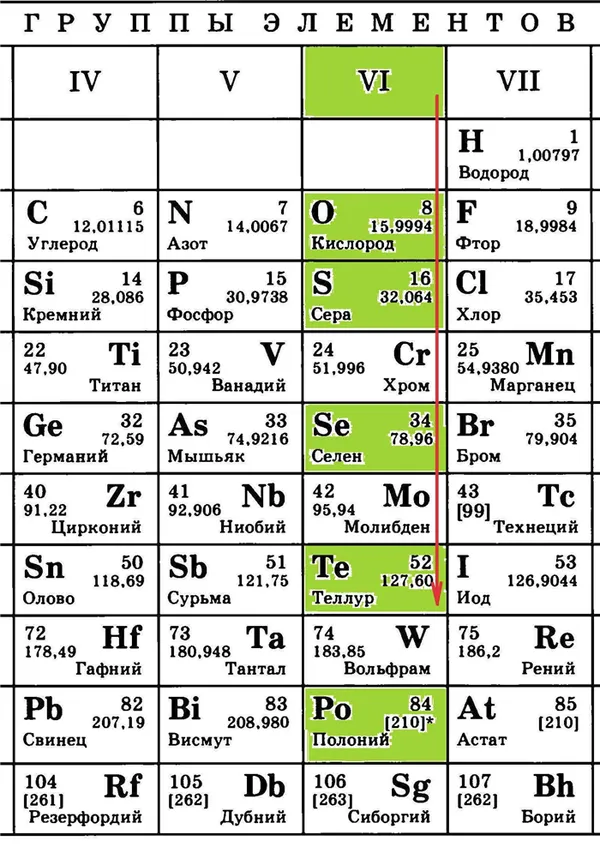
Таким образом, среди элементов главной подгруппы VI группы кислород обладает самой сильной окислительной силой, в то время как теллур при определенных взаимодействиях может проявлять восстановительные свойства.
4) Степень окисления (см. выше) можно использовать для определения того, как частица (или вещество, к которому она принадлежит) ведет себя в окислительно-восстановительном процессе.
Сильные или слабые окислители и восстановители: как определить
Ее часто называют: сильный окислитель, слабый окислитель, сильный восстановитель, слабый восстановитель. Но что это означает? И как точно определить эту силу?
Одной из мер окислительно-восстановительного потенциала вещества является значение стандартного электродного потенциала: чем оно выше, тем сильнее окислительно-восстановительные свойства.

Давайте рассмотрим таблицу стандартных электродных потенциалов. В ней значения потенциалов расположены в порядке убывания: Значения восстановительных стандартных потенциалов фтора и лития следующие.
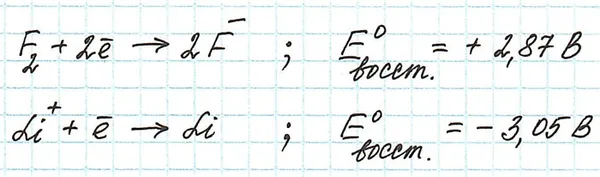
Из анализа этих полувзаимодействий и значений восстановительных потенциалов можно сделать вывод, что атомы фтора более окислены, чем остальные: Как восстановленные ионы, они принимают электроны легче, чем другие. Ионы лития также восстанавливаются, только с большим трудом.
Потенциалы окисления фтора и лития будут иметь противоположные значения.
Они говорят о том, что ион фтора трудно окислить, а атом лития легко превращается в ион при окислении.
Пример.

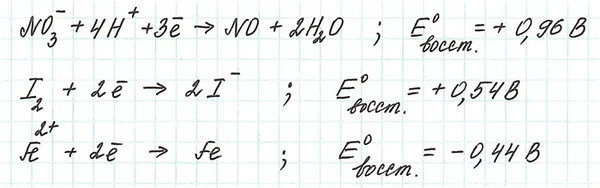
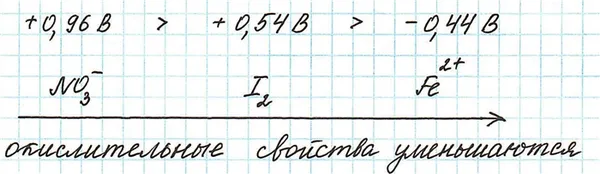
Поэтому самым сильным окислителем среди присутствующих является нитрат-ион.
Основные окислители и восстановители в химии
В технике используется множество окислителей и восстановителей с различной окислительной и восстановительной силой.
В таблице приведены наиболее важные из них:

Таким образом, окисление и восстановление — это два взаимосвязанных процесса. Они широко распространены в природе и играют важную роль в промышленном производстве. Окисляющие и восстанавливающие вещества очень разные. Является ли частица (или вещество, к которому она принадлежит) окислителем или восстановителем, можно определить по определенным закономерностям.
Чтобы первыми узнавать о новых публикациях на сайте, вступайте в группу ВКонтакте.